Chiều 29-7, Chủ tịch nước Nguyễn Xuân Phúc đã có chuyến thăm trụ sở Nanogen, doanh nghiệp tư nhân đang tham gia chương trình vaccine quốc gia với sản phẩm Nano Covax ở giai đoạn 3, những bước thử nghiệm cuối cùng.
Chuyến thăm của Chủ tịch nước Nguyễn Xuân Phúc tới Nanogen là tiếp nối của hàng loạt sự kiện, như chuyến thăm trước đó, hôm 26-6 của Thủ tướng Chính phủ Phạm Minh Chính, rồi nghị quyết kỳ họp thứ nhất mà Quốc hội (QH) khóa XV vừa bấm nút thông qua ngay trong ngày làm việc cuối cùng, hôm 28-7. Đây là những tín hiệu hậu thuẫn mạnh mẽ cho các nhà sản xuất thuốc nội địa, bao gồm vaccine trong lúc nguồn cung ứng từ bên ngoài còn rất khan hiếm.
Cửa mở pháp lý từ nghị quyết của Quốc hội
Trở lại với nghị quyết kỳ họp thứ nhất QH khóa XV, phần quan trọng được mong đợi là các giải pháp cấp bách mà QH giao Chính phủ thực hiện để phòng chống dịch COVID-19. Trong đó, đáng chú ý là QH giao Chính phủ, Thủ tướng “quyết định và tổ chức thực hiện các biện pháp chưa được luật quy định hoặc khác với quy định trong các luật, pháp lệnh hiện hành để đáp ứng yêu cầu cấp bách của công tác phòng chống dịch COVID-19 về áp dụng cơ chế đặc biệt, đặc thù, đặc cách trong cấp phép, đăng ký lưu hành, sản xuất, mua sắm thuốc…”.
Trao đổi với Pháp Luật TP.HCM, bà Đinh Thị Thu Thủy, Vụ phó Vụ Pháp chế, Bộ Y tế, đánh giá nghị quyết của QH đã giúp tháo gỡ một số vướng mắc nằm ở Luật Dược, mà nếu căn cứ vào đó thì không thể cấp phép khẩn cấp với các vaccine nội đang trong quá trình nghiên cứu, thử nghiệm lâm sàng.
Theo Luật Dược, thuốc - bao gồm vaccine - phải vượt qua cả ba giai đoạn thử nghiệm lâm sàng thì mới được cấp đăng ký lưu hành. Trong đó, giai đoạn 3 là rất quan trọng, theo đó cần thử nghiệm trên quy mô lớn “để đánh giá hiệu quả bảo vệ và tính an toàn của vaccine trên đối tượng đích”.
Trong hai tiêu chí này, mất nhiều thời gian nhất là các thử nghiệm để đánh giá hiệu quả bảo vệ. “Các quy định pháp luật về thử nghiệm thuốc của Việt Nam được xây dựng trên cơ sở tuân thủ các hướng dẫn chuyên môn của Tổ chức Y tế Thế giới. Trong điều kiện bình thường, để vượt qua các giai đoạn thử nghiệm như vậy, với vaccine sẽ cần rất nhiều năm. Mà như thế khó đáp ứng được tính khẩn cấp trong phòng chống đại dịch COVID-19” - bà Thủy cho biết.
Thách thức về thời gian
Nano Covax của Nanogen đang phải đối mặt với những thách thức pháp lý.
Vaccine này đang thử nghiệm giai đoạn 3 với 13.000 tình nguyện viên (TNV) ở Hà Nội, Hưng Yên, Long An, Tiền Giang tham gia. Tất cả TNV này đã được tiêm mũi 1, dự kiến ngày 15-8 sẽ hoàn tất tiêm mũi 2. Theo đề cương nghiên cứu đã được Bộ Y tế phê duyệt, 42 ngày sau tiêm mũi 1, tức 14 ngày sau tiêm mũi 2, thì mới có thể lấy mẫu máu TNV để tiến hành đánh giá trong phòng thí nghiệm về các chỉ số trung hòa virus. Trong các thí nghiệm này, có trường hợp phải nuôi cấy 21 ngày mới ra kết quả.
Như thế, nếu theo quy trình thông thường, áp dụng cho cả 13.000 TNV thì phải cuối tháng 9, đầu tháng 10 mới có kết quả đánh giá trong quy mô phòng thí nghiệm.
Nhưng trong phát triển thuốc, các kết quả đánh giá từ phòng thí nghiệm là chưa đủ. Vậy nên nhiệm vụ của thử nghiệm lâm sàng giai đoạn 3 còn là đánh giá hiệu quả bảo vệ của Nano Covax trên quy mô mẫu lớn.
Cụ thể, phải theo dõi dịch tễ 13.000 TNV tham gia thử nghiệm giai đoạn 3, sau 14 ngày kể từ khi tiêm mũi 2, thì có bao nhiêu người nhiễm virus SARS-CoV-2, nếu nhiễm thì có phát bệnh không, tính chất, mức độ thế nào.
Số lượng ca bệnh “bắt” được ấy phải đủ lớn để tiến hành tính toán, so sánh xem bao nhiêu thuộc nhóm tiêm giả dược, bao nhiêu là tiêm vaccine. Trên cơ sở đó mới có tính toán về hiệu quả bảo vệ của sản phẩm NanoCovax.
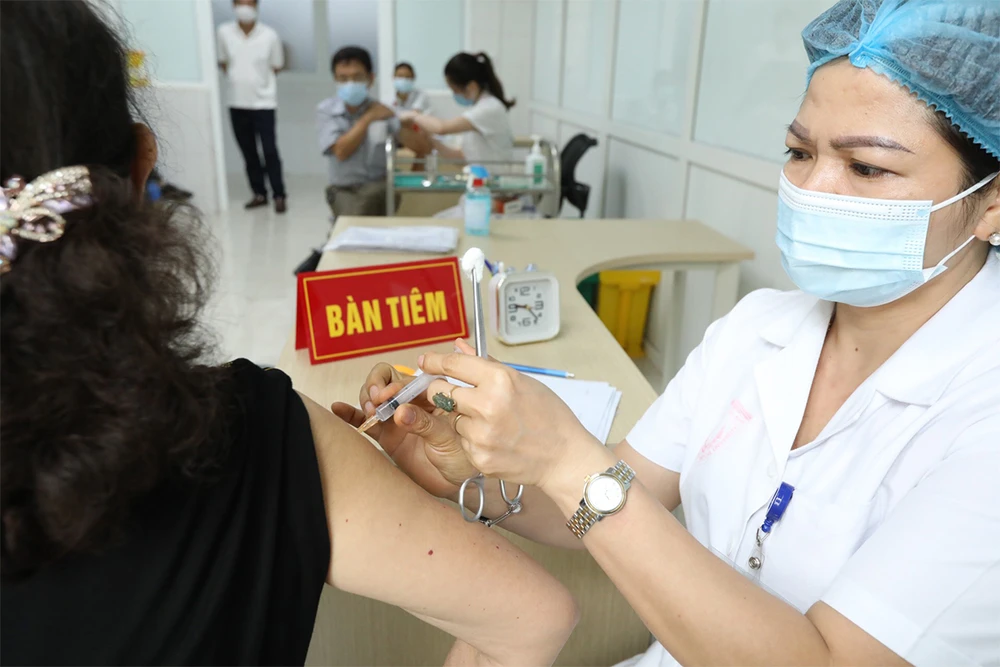
Tiêm thử nghiệm giai đoạn 3 vaccine Nano Covax. Ảnh: VGP
| Đánh giá cao nỗ lực của Nanogen trong nghiên cứu, thử nghiệm vaccine Nano Covax, Chủ tịch nước Nguyễn Xuân Phúc cho biết ông sẽ có ý kiến với Chính phủ, Bộ Y tế để tiếp tục rút gọn thủ tục hành chính, sớm ban hành quy trình, thủ tục chặt chẽ để có thể phê duyệt, cấp phép sớm nhất cho NanoCovax. |
Vẫn là câu hỏi về hiệu quả bảo vệ
Nghị quyết mà QH vừa thông qua chính là trao cho Chính phủ quyền xem xét, quyết định cấp phép, đăng ký lưu hành vaccine khi chưa hoàn tất cả ba giai đoạn thử nghiệm trên lâm sàng theo Luật Dược.
Về phía Bộ Y tế, chuẩn bị cho tình huống ấy, một dự thảo thông tư về cấp phép, đăng ký lưu hành vaccine trong tình huống khẩn cấp cũng đang được hoàn thiện. Sớm nhất là khi nghị quyết kỳ họp thứ nhất của QH khóa XV có hiệu lực, quy trình đặc biệt cho các vaccine nội địa, mà hiện NanoCovax đang dẫn đầu, có thể sẽ được Bộ Y tế báo cáo Chính phủ để ban hành.
Nhưng đó chỉ là sự chuẩn bị về hành lang pháp lý. Câu hỏi lớn nhất vẫn là Nanogen cùng với Học viện Quân y - đơn vị chủ trì tổ chức thử nghiệm trên lâm sàng Nano Covax có thu thập được đủ dữ liệu hoặc phương pháp khoa học đủ để chứng minh hiệu quả bảo vệ của vaccine nội này trước SARS-CoV-2 với các biến chủng ngày càng nguy hiểm của nó?
| Chủ tịch nước ủng hộ Nanogen phát triển Nano Covax Trong một tiếng làm việc cuối buổi chiều tại trụ sở Nanogen, Chủ tịch nước Nguyễn Xuân Phúc cho biết ông ủng hộ và sẵn sàng hỗ trợ để doanh nghiệp tư nhân này phát triển thành công vaccine Nano Covax cũng như các loại thuốc điều trị bệnh nhân COVID-19 khác. Chủ tịch nước cho biết vaccine cùng 5K đang là các giải pháp duy nhất hy vọng giúp kiểm soát tốc độ lây lan của virus SARS-CoV-2. Vì vậy, từ rất sớm không chỉ các bộ Y tế, Ngoại giao mà trực tiếp các lãnh đạo cấp cao của Đảng, Nhà nước cũng triển khai các hoạt động đối ngoại, mong tiếp cận được nhiều, sớm nhất vaccine mà các nước đã phát triển thành công. Tuy nhiên, tình hình chung, vaccine vẫn rất khan hiếm. Vậy nên nhiệm vụ phát triển vaccine nội địa, góp phần tự chủ được năng lực phòng chống dịch là rất cấp thiết, đặt lên vai ngành y tế và các đơn vị, doanh nghiệp sản xuất trong nước. |